Teste do produto não estéril
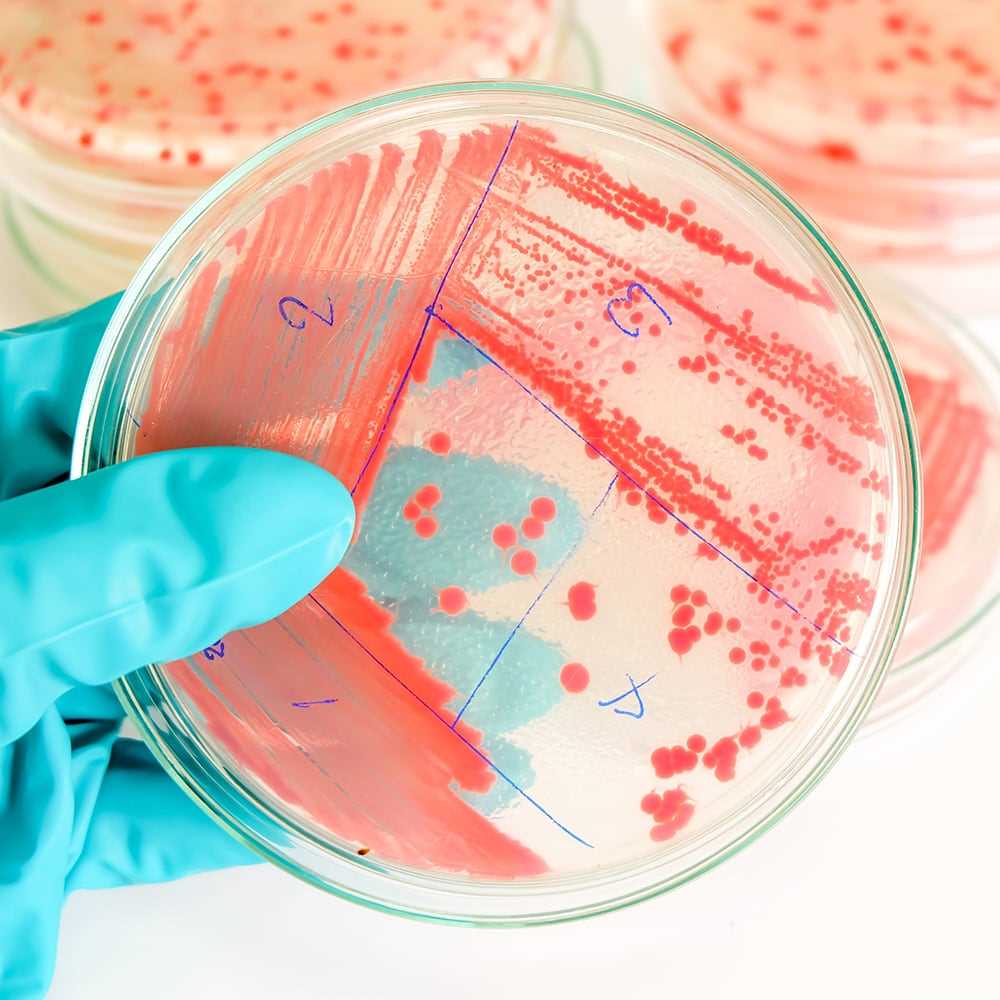
Os testes são suportados de acordo com os requisitos de compêndio harmonizados para o Exame Microbiológico de Produtos Não Esterilizados e os Testes para Microrganismos Especificados, normalmente pelos métodos de Filtração por Membrana ou Contagem de Placas. A ALS avalia a adequação dos métodos de teste selecionados, demonstrando a recuperação de microrganismos na presença do produto, antes dos testes de rotina.
A ALS lida habitualmente com uma vasta gama de matrizes de amostras, incluindo antibióticos mais agressivos, API, desinfetantes e fórmulas aquosas carregadas de conservantes, que podem necessitar de neutralização para a remoção da atividade antimicrobiana paralelamente à demonstração científica da ausência de toxicidade do neutralizador. A adequação do método de contagem deve ser demonstrada na presença do produto.
Todas as instalações da ALS esforçam-se por alcançar as melhores práticas da indústria, incluindo as recomendações estabelecidas no Capítulo USP, <1117> entre outros. Embora não sejam exaustivos, os critérios de aceitação dos Compêndios usados para a qualidade microbiológica de formas de dosagem não estéreis são definidos, principalmente, pela via de administração apoiada por avaliações de impacto baseadas no risco, conforme referido na USP. <1111>A necessidade de controlos adicionais de microrganismos censuráveis deve ser determinada para cada produto. Os critérios alternativos são aplicáveis a API, medicamentos à base de plantas e suplementos dietéticos, embora, em qualquer caso, os requisitos típicos incluam:
Testes de enumeração microbiana
- Contagem microbiana aeróbica total (TAMC)
- Contagem total combinada de fungos e bolores (TYMC)
Microrganismos Especificados
- Staphylococcus aureus
- Pseudomonas aeruginosa
- Escherichia coli
- Salmonela
- Candida albicans
- Bactérias Gram-negativas tolerantes à bile (BTGN)
- Clostridia
- Burkholderia cepacia (BCC)
Embora os compêndios sejam harmonizados para a maioria das formas de dosagem não estéreis, os testes são realizados de acordo com:
- USP (61) Exame Microbiológico de Produtos Não Esterilizados: Testes de enumeração microbiana
- USP (62) Exame Microbiológico de Produtos Não Esterilizados: Testes para Microrganismos Especificados
- Ph. Método Eur. 2.6.13 Exame Microbiológico de Produtos Não Esterilizados
- Ph. Método Eur. 2.6.12 Testes de Enumeração Microbiana
A ALS pode incluir outros microrganismos especificados em regimes de teste, tais como isolados da monitorização ambiental, onde existam riscos conhecidos.
Outros métodos de teste, incluindo métodos microbiológicos rápidos, podem ser usados para teste do produto, embora necessitem de validação para demonstrar a sua adequação e equivalência aos métodos compendiais. Como Projetos Técnicos, a ALS pode apoiar o desenvolvimento e validação de procedimentos alternativos.
As determinações da atividade da água podem ser suportadas de acordo com métodos USP <922> e Ph. Eur. 2.9.39.
Caracterização Física e Estrutural
 Procurar
Procurar
 português
português
 Iniciar sessão
Iniciar sessão